Los ensayos clínicos son esenciales para avanzar en la ciencia médica y proporcionar a los pacientes tratamientos novedosos. La optimización de las operaciones de los ensayos clínicos depende críticamente de una gestión de datos efectiva y del cumplimiento de las directrices de CDISC.
La gestión de datos clínicos es la recopilación, organización, validación y análisis sistemático de los datos producidos durante los ensayos clínicos y las actividades de investigación en el ámbito de la salud (1). También es el proceso de recopilar, limpiar y gestionar los datos de los sujetos en cumplimiento de las normas regulatorias. El objetivo principal del proceso de gestión de datos clínicos es proporcionar datos de alta calidad manteniendo el número de errores y datos faltantes lo más bajo posible, recopilando el máximo de datos para su análisis.(2)
La gestión de datos de los ensayos clínicos es una tarea compleja. Comienza con el diseño y desarrollo de los formularios de informe de estudio (CRF), la entrada de datos, la limpieza de datos y el proceso de bloqueo de la base de datos, hasta la extracción de datos y su transmisión a los estadísticos para su análisis final (3). Este proceso involucra a todas las partes interesadas: médicos, investigadores, epidemiólogos, CRA, directores de proyecto y todas las personas relacionadas con la operación del ensayo clínico.
Esta actividad se realiza de forma paralela durante la ejecución del ensayo. Incluye la planificación de la captura de datos, la validación del software, los controles de calidad, la resolución de inconsistencias de datos y la preparación de conjuntos de datos para el análisis y la presentación de informes. La gestión de datos clínicos incluye actividades como el seguimiento de los ensayos clínicos, los informes de consultas, el análisis intermedio, las revisiones de la base de datos, la limpieza de consultas, el congelamiento y la entrega de la base de datos para la toma de decisiones temprana.
Uno de los principales objetivos de la gestión de datos clínicos es apoyar el objetivo general del ensayo y satisfacer las necesidades de datos bajo un único principio ético: beneficiar a las personas. Para ello, los patrocinadores deben tomar decisiones sobre la seguridad, la eficacia y los posibles beneficios con datos limpios y fiables a lo largo de la ejecución del ensayo. Este es uno de los motivos por los que la gestión de datos es tan importante.
Otro objetivo importante de la gestión de datos clínicos es producir datos de alta calidad, coherentes y fiables que permitan un análisis exhaustivo y faciliten las presentaciones regulatorias. Por eso es fundamental garantizar la validez e integridad de los resultados de la investigación clínica, apegándose a protocolos definidos y utilizando técnicas de control de calidad estrictas.
Por lo tanto, los bioestadísticos deben analizar datos limpios, reales, precisos, seguros, lógicos, relacionados y fiables con variables detalladas, sujetos, intervenciones y estadísticas bien descritas.
Estandarización de la gestión de datos de los ensayos clínicos
CDASH y SDTM proporcionan un marco para la recopilación y estandarización de los datos de los ensayos clínicos, lo que permite un análisis y evaluación rápidos por parte de las agencias reguladoras.
CDASH fue creado por la iniciativa del Clinical Data Interchange Standards Consortium (CDISC). CDSIC inició el trabajo en los estándares CDASH en octubre de 2006. Fue un esfuerzo interdisciplinario (gestores de datos, estadísticos, monitores médicos y programadores). Desde entonces, las normas han sido adoptadas por tres regiones de la International Conference on Harmonization (ICH): Estados Unidos, Europa y Japón (4). La última versión de CDASH y la actual, la 1.2, se publicó el 28 de septiembre de 2021, y la última versión de SDTM v2.0 el 29 de noviembre de 2021. (5)
CDISC tiene como objetivo «desarrollar y avanzar en las normas de datos de la más alta calidad para transformar formatos incompatibles, metodologías inconsistentes y perspectivas diversas en un poderoso marco para generar datos de investigación clínica que sean lo más accesibles posible» Además, la estandarización ha dado lugar a procesos más seguros y ha garantizado la integridad de los datos durante las transferencias de bases de datos. A continuación se presentan las normas de datos según CDISC:
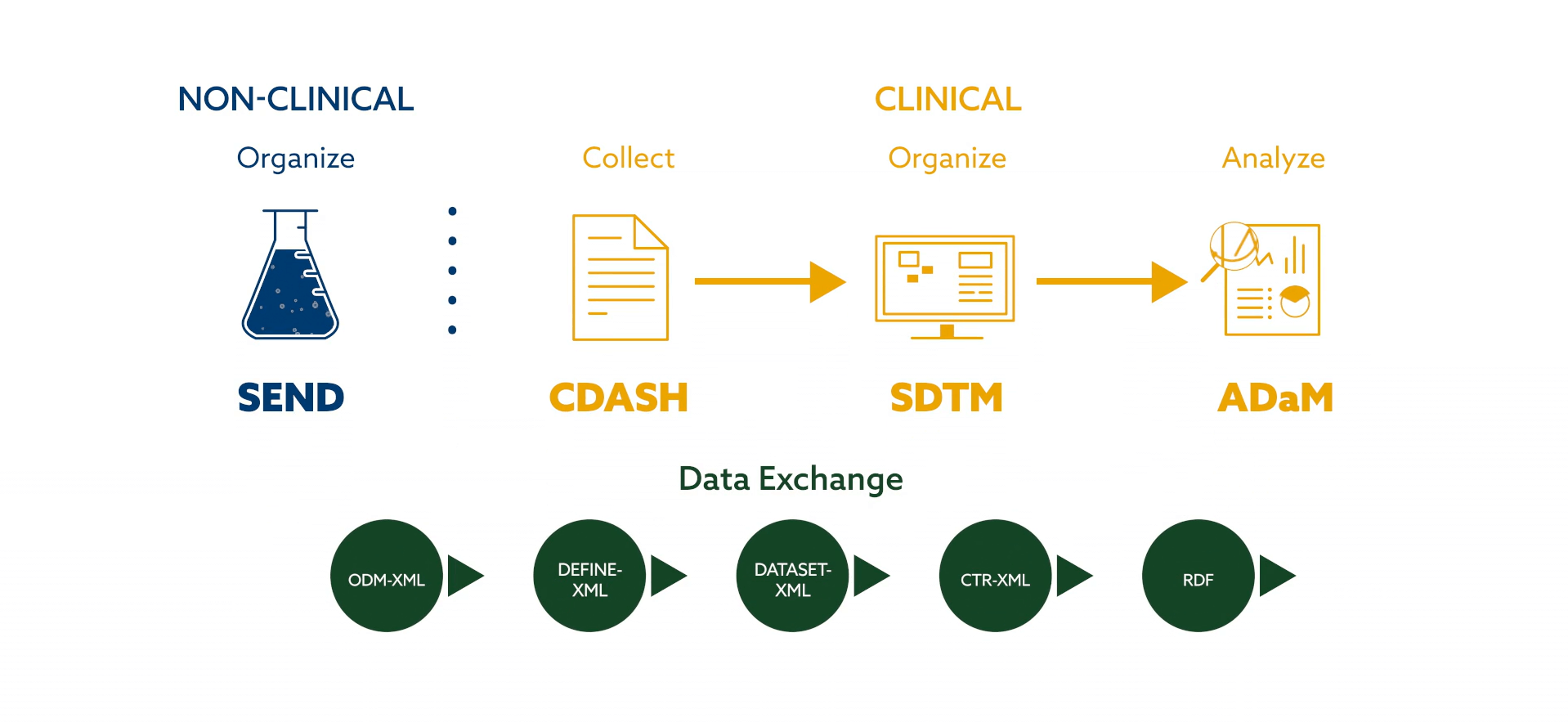
La implementación de técnicas de gestión de datos y el cumplimiento de las normas CDASH/SDTM/ADaM ofrecen diversas ventajas durante el ensayo clínico; la mejora de la calidad de los datos, el análisis más rápido, las presentaciones regulatorias más rápidas y la mayor eficiencia operativa contribuyen a la excelencia en los resultados de los ensayos clínicos.
Las organizaciones pueden mejorar sus procesos de ensayos clínicos, las investigación médica y el desarrollo de medicamentos y vacunas adoptando estas mejores prácticas y utilizando las últimas tecnologías.
Referencias:
- Krishnankutty B, Bellary S, Kumar NB, Moodahadu LS. Data management in clinical research: An overview. Indian J Pharmacol. 2012 Mar;44(2):168-72. doi: 10.4103/0253-7613.93842. PMID: 22529469; PMCID: PMC3326906. Link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3326906/
- Gerritsen MG, Sartorius OE, vd Veen FM, Meester GT. Data management in multi-center clinical trials and the role of a nation-wide computer network. A 5-year evaluation. Proc Annu Symp Comput Appl Med Care. 1993:659–62. Link:
https://www.nia.nih.gov/research/dgcg/nia-glossary-clinical-research-terms - Gaddale JR. Clinical Data Acquisition Standards Harmonization importance and benefits in clinical data management. Perspect Clin Res. 2015 Oct-Dec;6(4):179-83. doi: 10.4103/2229-3485.167101. PMID: 26623387; PMCID: PMC4640009. Link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4640009/
https://www.cdisc.org/about












